Αλμπερτ Μπουρλά: “Υπερήφανος για την παρασκευή του χαπιού της Pfizer”

Ο Αλμπέρτ Μπουρλά ανέβασε τις πρώτες φωτογραφίες με τους ερευνητές της Pfizer να κρατούν στα χέρια τους το χάπι κατά του κοροναϊού. Την Τρίτη η εταιρεία κατέθεσε αίτηση για την έγκριση του χαπιού κατά του κορωνοϊού στον αμερικανικό FDA.
Μόλις μια μέρα μετά το αίτημα της Pfizer για την κατεπείγουσα έγκριση του πειραματικού αντιιικού χαπιού της για τη νόσο Covid-19, o CEO της εταιρείας ανάρτησε στα social media δύο φωτογραφίες με τους ερευνητές την ώρα της παραγωγής των χαπιών αλλά και λίγο μετά κρατώντας στα χέρια τους το φαρμακευτικό σκεύασμα.
Η ανάρτηση
Στην ανάρτησή του ο Αλμπερτ Μπουρλά γράφει: «Η πρώτη παρτίδα χαπιών για την Ένωση των Ευρωπαϊκών Πανεπιστημίων. Είμαι πολύ περήφανος που γιορτάζω την ικανότητα των συναδέλφων μας να προωθήσουν γρήγορα το υποψήφιο φάρμακο που θα χορηγείται από το στόμα. Είναι ένα αγαθό προς όφελος της ανθρωπότητας».
This is the power of our science on full display: The first batch of tablets for potential EUA. I am so very proud to celebrate our colleagues’ ability to rapidly advance our COVID-19 oral antiviral candidate — a homegrown asset — to hopefully benefit humankind. pic.twitter.com/C6GlEfg72r
— Albert Bourla (@AlbertBourla) November 17, 2021
Το αίτημα
Η Pfizer ανέφερε ότι ολοκλήρωσε την υποβολή της αίτησής της στην Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για να λάβει την κατεπείγουσα έγκριση χρήσης (EUA) του φαρμάκου Paxlovid. Μεταξύ άλλων υπέβαλε και δεδομένα από την κλινική δοκιμή του φαρμάκου.
Το χάπι αυτό ενδέχεται να είναι ένα πολλά υποσχόμενο νέο όπλο στη μάχη κατά της πανδημίας αφού μπορεί να χορηγηθεί στο σπίτι, στην αρχή της νόσησης, ως θεραπεία που θα βοηθούσε να αποφευχθούν οι νοσηλείες και οι θάνατοι. Θα μπορούσε επίσης να μετατραπεί σε σημαντικό εργαλείο σε χώρες και περιοχές με περιορισμένη πρόσβαση σε εμβόλια ή με χαμηλά ποσοστά εμβολιασμού.
Τι ανέφερε ο Άλμπερτ Μπουρλά
Δεν έχει διευκρινιστεί ακόμη πότε θα εξεταστεί το αίτημα της Pfizer. Οι εταιρείες Merck & Co Inc και Ridgeback Biotherapeutics, που αναπτύσσουν ένα ανταγωνιστικό σκεύασμα, το molnupiravir, ολοκλήρωσαν την υποβολή της αίτησής τους στις 11 Οκτωβρίου. Μια επιτροπή εξωτερικών συμβούλων της FDA θα συνεδριάσει για να εξετάσει αυτό το αίτημα στις 30 Νοεμβρίου και η απόφαση αναμένεται να ληφθεί εντός του έτους.
«Προχωράμε όσο το δυνατόν γρηγορότερα στις προσπάθειές μας να φέρουμε στους ασθενείς αυτήν την πιθανή θεραπεία και προσδοκούμε να εργαστούμε με την FDA στην εξέταση της αίτησής μας, καθώς και με άλλες ρυθμιστικές αρχές σε όλον τον κόσμο», ανέφερε σε ένα δελτίο Τύπου ο Άλμπερτ Μπουρλά, ο διευθύνων σύμβουλος της Pfizer.
Η φαρμαβιομηχανία διευκρίνισε ότι έχει ξεκινήσει παρόμοιες διαδικασίες για την έγκριση του φαρμάκου της σε πολλές άλλες χώρες, όπως στο Ηνωμένο Βασίλειο, την Αυστραλία, τη Νέα Ζηλανδία και τη Νότια Κορέα. Νωρίτερα σήμερα η Pfizer έκανε γνωστό ότι θα επιτρέψει σε παρασκευάστριες εταιρείες γενοσήμων φαρμάκων να εφοδιάσουν με το σκεύασμά της για την Covid-19 95 χώρες με χαμηλά και μεσαία εισοδήματα.
Διαβάστε όλες τις τελευταίες Ειδήσεις από την Ελλάδα και τον Κόσμο




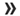


























Το σχόλιο σας